Opracowywanie szczepionek jest zazwyczaj długim, złożonym procesem, zwykle trwającym 10–15 lat. W Unii Europejskiej nadzór nad szczepionkami i innymi lekami sprawuje Europejska Agencja Leków (EMA, European Medicines Agency), a Światowa Organizacja Zdrowia (WHO, World Health Organization) wydaje zalecenia dotyczące produktów biologicznych stosowanych na arenie międzynarodowej. Wiele krajów przyjęło standardy WHO.
Spis treści:
- Szczepionka co to jest?
- Etapy powstawania szczepionki
- Dlaczego szczepionka na COVID-19 powstała tak szybko?
- Czy szybkość opracowywania szczepionek na COVID-19 zagraża bezpieczeństwu?
Szczepionka co to jest?
W uproszczeniu, szczepionka to preparat biologiczny, zawierający osłabione lub zabite formy drobnoustroju bądź pochodzące z niego antygeny (np. jego toksyny lub białko powierzchniowe), które po podaniu wywołują nabycie odporności przeciw danemu drobnoustrojowi.
Podanie szczepionki ma imitować naturalną infekcję i prowadzić do rozwoju odporności analogicznej, do tej którą uzyskuje organizm w czasie pierwszego, naturalnego, kontaktu z drobnoustrojem (bakterią lub wirusem).
Etapy powstawania szczepionki
W Polsce za kontrolę i nadzór nad szczepionkami odpowiadają Główny Inspektorat Farmaceutyczny oraz Główny Inspektorat Sanitarny.
Za kontrolę seryjną wstępną odpowiada Zakład Badań Surowic i Szczepionek PZH, natomiast Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych wydaje pozwolenie na dopuszczenie do obrotu szczepionki w Polsce.
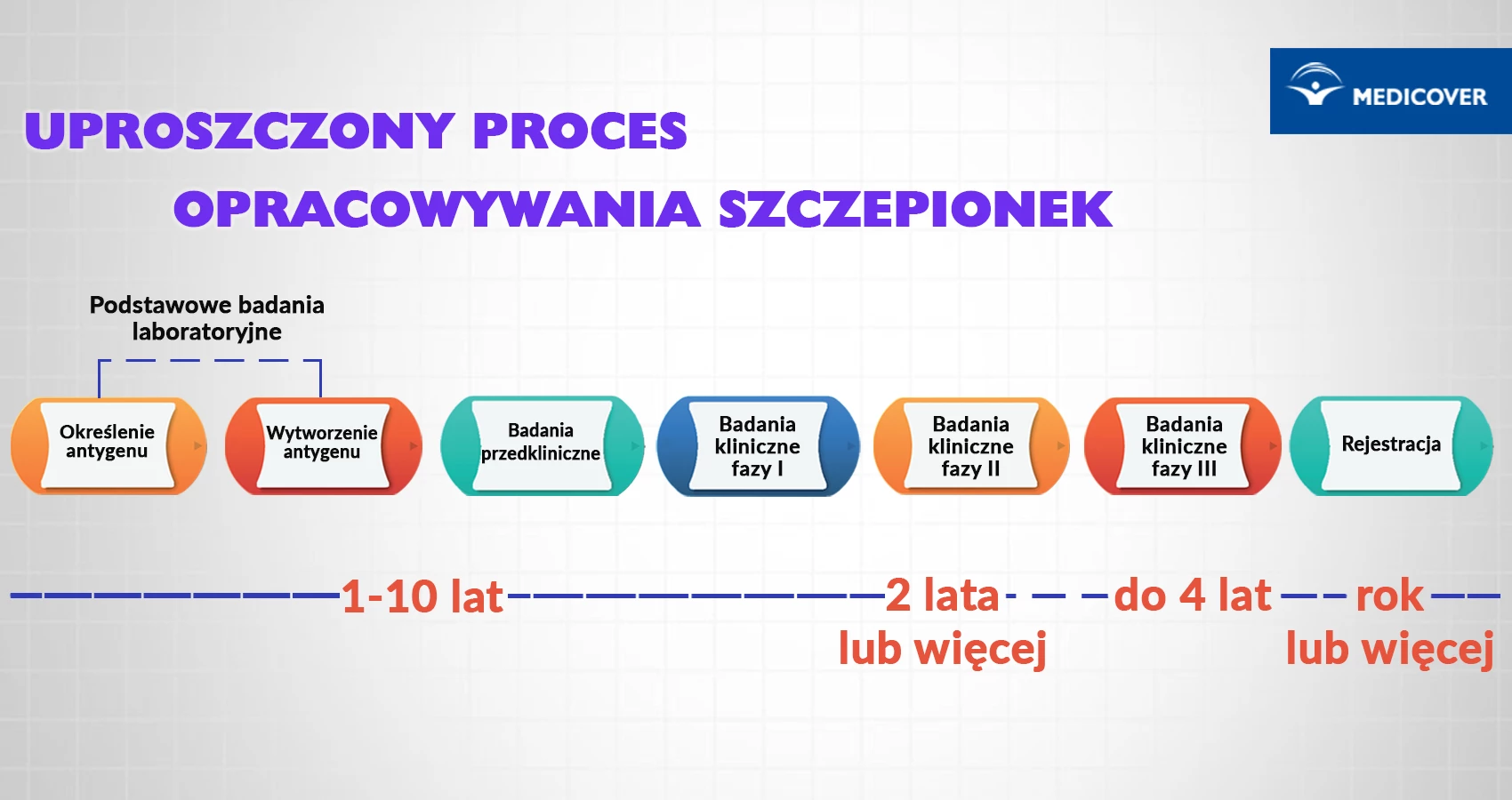
Etap badań przedklinicznych: badania laboratoryjne
Pierwszym etapem w procesie powstawania szczepionki jest etap badań laboratoryjnych i zwykle trwa 2-4 lata. Po zidentyfikowaniu drobnoustroju wywołującego daną chorobę, naukowcy szukają antygenów, czyli cząstek wirusopodobnych, osłabionych wirusów lub bakterii, osłabionych toksyn bakteryjnych bądź innych substancji pochodzących z patogenów, które mogą wywołać odpowiedź immunologiczną, czyli wzbudzić produkcję przeciwciał w organizmie gospodarza.
W przypadku wirusa SARS-CoV-2 antygenem jest tzw. białko szczytowe koronawirusa (znajduje się na szczycie cząsteczki koronawirusa). Jest to część wirusa, którą układ odpornościowy „zapamiętuje”.
Etap badań przedklinicznych: eksperymenty laboratoryjne i badania na zwierzętach
Ta faza badań ma na celu poznanie sposobu działania danej szczepionki i jej wpływu na organizm. W badaniach przedklinicznych wykorzystuje się systemy hodowli tkankowej lub hodowli komórkowej oraz testy na zwierzętach.
Przeprowadza się je w celu oceny bezpieczeństwa szczepionki i jej immunogenności, czyli zdolności do wywołania odpowiedzi immunologicznej. Na podstawie tych badań naukowcy określają, jakich reakcji komórkowych mogą spodziewać się u ludzi. Wyniki badań pomagają również określić bezpieczną dawkę początkową do następnej fazy badań, a także bezpieczną metodę podawania szczepionki.
Na tym etapie naukowcy mogą także zmodyfikować szczepionkę, aby zwiększyć jej skuteczność lub przeprowadzić badania prowokacyjne na zwierzętach, co oznacza, że szczepią zwierzęta, a następnie próbują zarazić je docelowym patogenem.
Wiele szczepionek nigdy nie wykracza poza ten etap, ponieważ nie wywołuje pożądanej odpowiedzi immunologicznej. Etapy przedkliniczne często trwają 1-2 lata.
Etap kliniczny
Po pozytywnym przejściu etapu badań przedklinicznych, firma farmaceutyczna na podstawie raportów z badań, składa wniosek o poddanie szczepionki testom klinicznym z udziałem ludzi.
Po zatwierdzeniu wniosku przez odpowiednie instytucje szczepionka jest poddawana trzem fazom testów, regulowanym przez międzynarodowe wytyczne. Każda faza musi zakończyć się wynikiem pozytywnym, aby można było przejść do kolejnej.
Faza I badanie bezpieczeństwa szczepionki
To pierwsza próba oceny bezpieczeństwa, odpowiedzi immunologicznej i tolerancji różnych dawek szczepionki z niewielką grupą ochotników, zwykle od 20 do 100 zdrowych osób dorosłych. Jeśli szczepionka jest przeznaczona dla dzieci, badacze najpierw testują osoby dorosłe, a następnie stopniowo obniżają wiek badanych osób.
Faza II badanie odpowiedzi układu odporności osób zaszczepionych i poszukiwanie optymalnej dawki
Celem testów fazy II jest zbadanie bezpieczeństwa szczepionki, immunogenności, proponowanych dawek, harmonogramu immunizacji i metody podania szczepionki.
Badania fazy II mogą trwać ponad 2 lata i obejmują grupę kilkuset osób (od 100 do 300 ochotników). Niektóre osoby mogą należeć do grup zagrożonych zachorowaniem. Badania kliniczne szczepionek można niekiedy przyspieszyć, wprowadzając fazę pośrednią (tzw. "proof-of-concept"), która umożliwia wstępną ocenę skuteczności nowej szczepionki. Zazwyczaj wymaga udziału 2000 do 9000 ochotników.
Faza III ostateczna ocena skuteczności i bezpieczeństwa pod kątem występowania niepożądanych odczynów poszczepiennych
Jednym z celów III fazy testów jest ocena bezpieczeństwa szczepionek w dużej grupie osób. Testowana jest również skuteczność szczepionki, czyli czy szczepionka zapobiega zachorowaniu, czy prowadzi do wytwarzania przeciwciał.
Bierze w niej udział 10 000 lub więcej ochotników. Badania fazy III mogą trwać do 4 lat.
Wszystkie badania są przeprowadzane z użyciem randomizacji (ochotnicy są przydzielani losowo do grupy kontrolnej z placebo i do grupy eksperymentalnej), z grupą kontrolną (zwykle otrzymującą placebo) i podwójnym zaślepieniem (ani prowadzący badanie, ani uczestnicy nie wiedzą, co otrzymuje uczestnik badania – lek czy placebo).
Po pozytywnym zakończeniu III fazy badań szczepionka może zostać zarejestrowana i wprowadzona do obrotu. Uzyskane wyniki badań jakości i bezpieczeństwa oraz wyniki skuteczności są poddane szczegółowej ocenie w procesie rejestracji szczepionki w EMA lub Urzędzie Rejestracji Produktów Leczniczych Wyrobów Medycznych i Produktów Biobójczych.
Po zarejestrowaniu szczepionki nadal prowadzone są badania porejestracyjne obejmujące uzupełniające badania kliniczne IV fazy.
Faza IV
Faza IV obejmuje badania, które firmy farmaceutyczne przeprowadzają po wyprodukowaniu szczepionki. Producent może kontynuować testowanie szczepionki pod kątem bezpieczeństwa (system zgłaszania zdarzeń niepożądanych), skuteczności i innych potencjalnych zastosowań.
Szczepionka podlega stałemu nadzorowi także po tym, jak zostanie wprowadzona do obrotu rynkowego.
Dlaczego szczepionka na COVID-19 powstała tak szybko?
Wraz z pojawieniem się zagrożenia epidemicznego w 2020 roku i wysokim tempem zakażeń SARS-CoV-2 na całym świecie powstała pilna potrzeba opracowania szczepionki przeciwko COVID-19.
W grudniu 2020 roku Komisja Europejska zatwierdziła pierwszą szczepionkę na COVID-19: Comirnaty firmy Pfizer/BioNTech.
| Wiele osób zastanawia się, dlaczego proces dopuszczenia szczepionki przeciwko COVID-19 do obrotu był tak szybki. |
|
Powstawanie szczepionek jest zwykle długim i kosztownym procesem z powodu opóźnień spowodowanych ubieganiem się o finansowanie, akceptacją etyczną, rekrutacją wolontariuszy, negocjacjami z producentami i zwiększaniem produkcji.
Niektóre szczepionki przeciwko COVID-19 opracowano przy użyciu nowych metod umożliwiających szybszą produkcję większych ilości niż w przypadku innych rodzajów szczepionek.
W czasie pandemii COVID-19 naukowcy na całym świecie, lekarze, komisje ds. etyki badań naukowych, producenci i agencje regulacyjne połączyli siły, aby pracować ciężej i szybciej.
Na czym polega warunkowe pozwolenie na dopuszczenie leku lub szczepionki do obrotu?
W sytuacji zagrożenia zdrowia publicznego możliwe jest wydanie warunkowego pozwolenia na dopuszczenie do obrotu leku lub szczepionki.
Dzieje się tak, gdy korzyści wynikające z natychmiastowego udostępnienia leku lub szczepionki przewyższają ryzyko związane z mniej obszernymi danymi niż wymagane w zwykłych okolicznościach. W takich przypadkach producent zobowiązuje się do udostępnienia dodatkowych informacji w określonych terminach.
W każdym wypadku Komisja Europejska wyda pozwolenie na dopuszczenie do obrotu jedynie wtedy, gdy ocena Europejskiej Agencji Leków wykaże, iż szczepionka jest zarówno bezpieczna, jak i skuteczna.
Ponadto wprowadzono szczególne środki w celu szybkiego gromadzenia i analizowania nowych informacji. Przykładowo producenci muszą zwykle co sześć miesięcy udostępniać Europejskiej Agencji Leków raport o bezpieczeństwie. W przypadku szczepionek przeciwko COVID-19 raporty o bezpieczeństwie muszą być przekazywane co miesiąc.
Czy szybkość opracowywania szczepionek na COVID-19 zagraża bezpieczeństwu?
Nie. Podczas badań klinicznych szczepionek na COVID-19 przestrzegano wszystkich standardowych procedur bezpieczeństwa, a rygorystyczne procesy regulacyjne zostały w pełni zakończone, podobnie jak w przypadku każdej innej szczepionki lub leku.
Należy pamiętać, że w zasadzie żaden lek nie jest całkowicie wolny od ryzyka ani w 100 proc. skuteczny. Jednak testy bezpieczeństwa zapewniają, że korzyści zdrowotne szczepionek czy leków przewyższają wszelkie ryzyko. Szczepionki na COVID-19 zostały opracowane bez uszczerbku dla jakości, bezpieczeństwa i skuteczności.
Źródła:
https://www.immunology.org/sites/default/files/BSI%20resource_How%20vaccine%20so%20fast.pdf
Dzieciątkowski T., Filipiak K.J., Koronawirus SARS-CoV-2. Zagrożenia dla współczesnego świata. Suplement 2021, PZWL, Warszawa 2021.
Autor: Beata Tarnowska, Specjalista ds. Informacji Medycznej Medicover

